猕猴桃籽油(KSO)是一种由猕猴桃籽压榨制成的植物油。它营养丰富,含有多种脂肪酸,尤其是不饱和脂肪酸。文章采用四氯化碳(CCl4)建立大鼠急性肝损伤(ALI)模型,探究KSO的肝脏保护作用。应用网络药理学预测活性化合物和关键靶点,并通过代谢组学和肠道菌群分析KSO的作用机制。
结果发现KSO改善肝脏组织学结构,显著降低血清促炎细胞因子水平,提高肝脏抗氧化能力。代谢组学分析显示,KSO可能通过参与色氨酸代谢、糖酵解/糖异生、半乳糖代谢、胆汁分泌等信号通路来调控代谢产物,从而发挥肝脏保护作用。肠道微生物学分析表明,KSO改善了肠道菌群的组成和数量。网络药理学和体内实验验证研究表明,KSO通过改变Ptgs2,Nos2,Ppara,Pparg和Serpine1的mRNA水平来发挥作用。因此,KSO具有肝脏保护作用,其机制与调节代谢紊乱和肠道菌群有关。
该文章以“Liver-gut axis including metabolomics and intestinal flora to discover the protective effects of Kiwifruit seed oil on CCl4-induced acute liver injury” 为题发表于中科院一区TOP期刊Food & Function杂志(IF 5.1)。
Introduction
肝脏是蛋白质合成、分解、解毒和氨基酸代谢的重要器官。它还具有生理解毒、吞噬和防御功能。其主要作用包括胆汁分泌、糖原储存以及调节蛋白质、脂类和碳水化合物的代谢。有研究表明,肝脏生理改变是肠屏障减弱的原因,导致肠道微生物群从肠腔转移到肝脏。CCl4处理后肠道菌群结构发生改变,并损伤肝脏。肠道菌群产生的代谢物和其他小分子化合物被宿主肠道吸收,可能影响宿主的代谢。非酒精性脂肪性肝病、糖尿病、肥胖等多种疾病已被证明与代谢异常密切相关。因此,通过分析健康和疾病状态之间的代谢物变化,可以发现用于疾病检测的生物标志物。
植物油主要由甘油和直链高脂肪酸酯组成,具有护肝、营养补充、抗糖尿病和肥胖等多种功效。猕猴桃具有广泛的生物活性,包括抗菌、抗炎和抗氧化。KSO含有75%以上的不饱和脂肪酸,包括亚油酸和α-亚麻酸(ALA),其中ALA占64%。通过摄入ALA可以增强大鼠高胆固醇饮食引起的脂质代谢量。此外,富含ALA的植物油可能对急性肝损伤有保护作用,但KSO在这方面的作用尚未被研究。
本研究采用UPLC-MS非靶向代谢组学、16S rDNA基因测序技术和网络药理学研究KSO对CCl4诱导肝损伤时代谢谱改变和肠道菌群失衡的影响。目的是阐明KSO的肝脏保护机制。本研究揭示了KSO对CCl4诱导的肝损伤具有保护作用,为进一步研究KSO与肝损伤和肠道菌群之间的关系提供了线索。
Results and Discussion
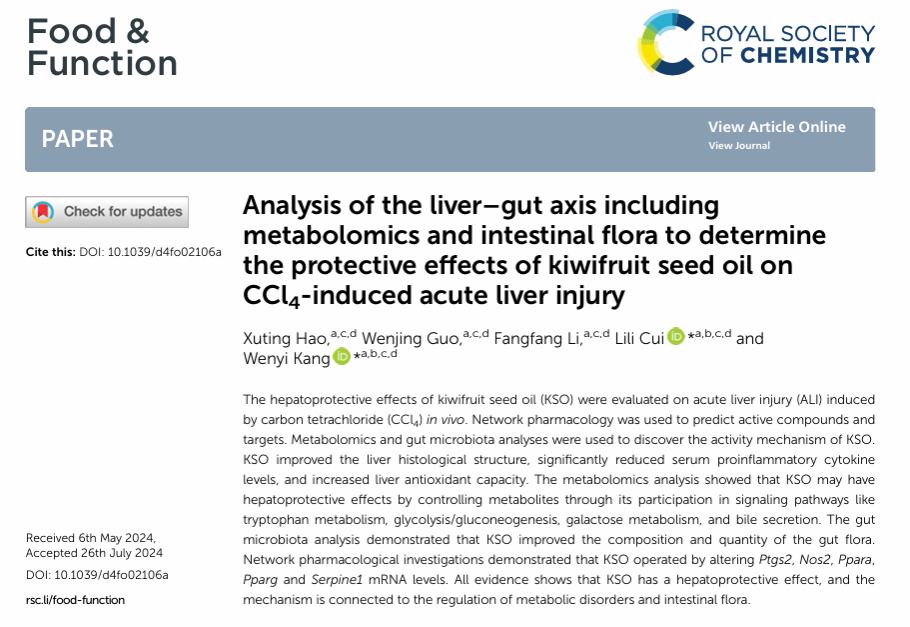
1. KSO的GC-MS分析
采用GC-MS分析KSO脂肪酸成分。在表2中,KSO的脂肪酸成分主要包括油酸、ALA、亚油酸、棕榈酸和硬脂酸。
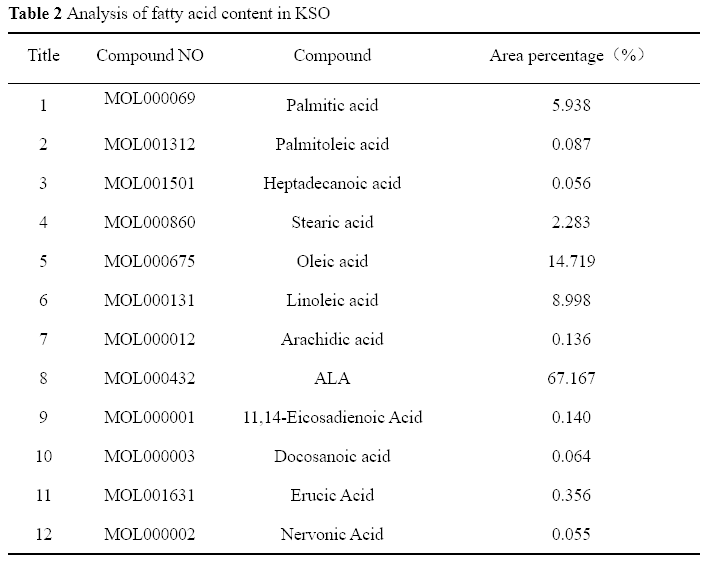
2. KSO对小鼠肝脏指数的影响
在表3中,MC组小鼠的肝脏系数明显高于BC组(P < 0.01),表明模型建立成功。与MC组比较,HD组和MD组小鼠肝脏系数明显降低(P < 0.001, P < 0.01), LD组肝脏系数有所降低,但差异无统计学意义(P > 0.05)。结果表明,KSO对CCl4诱导的肝肿大有改善作用,对肝脏有保护作用,且呈剂量依赖性。
3. KSO对ALT和AST的影响
在图1A和图B中,与BC组相比,MC组大鼠血清中AST和ALT含量明显升高(P < 0.001),表明模型建立成功。KSO高、中、低剂量组和PC组均能显著降低ALI小鼠血清AST含量(P < 0.01, P < 0.001)。HD组和PC组也显著降低了小鼠血清ALT含量(P < 0.01)。提示KSO具有降低小鼠AST和ALT活性的作用。
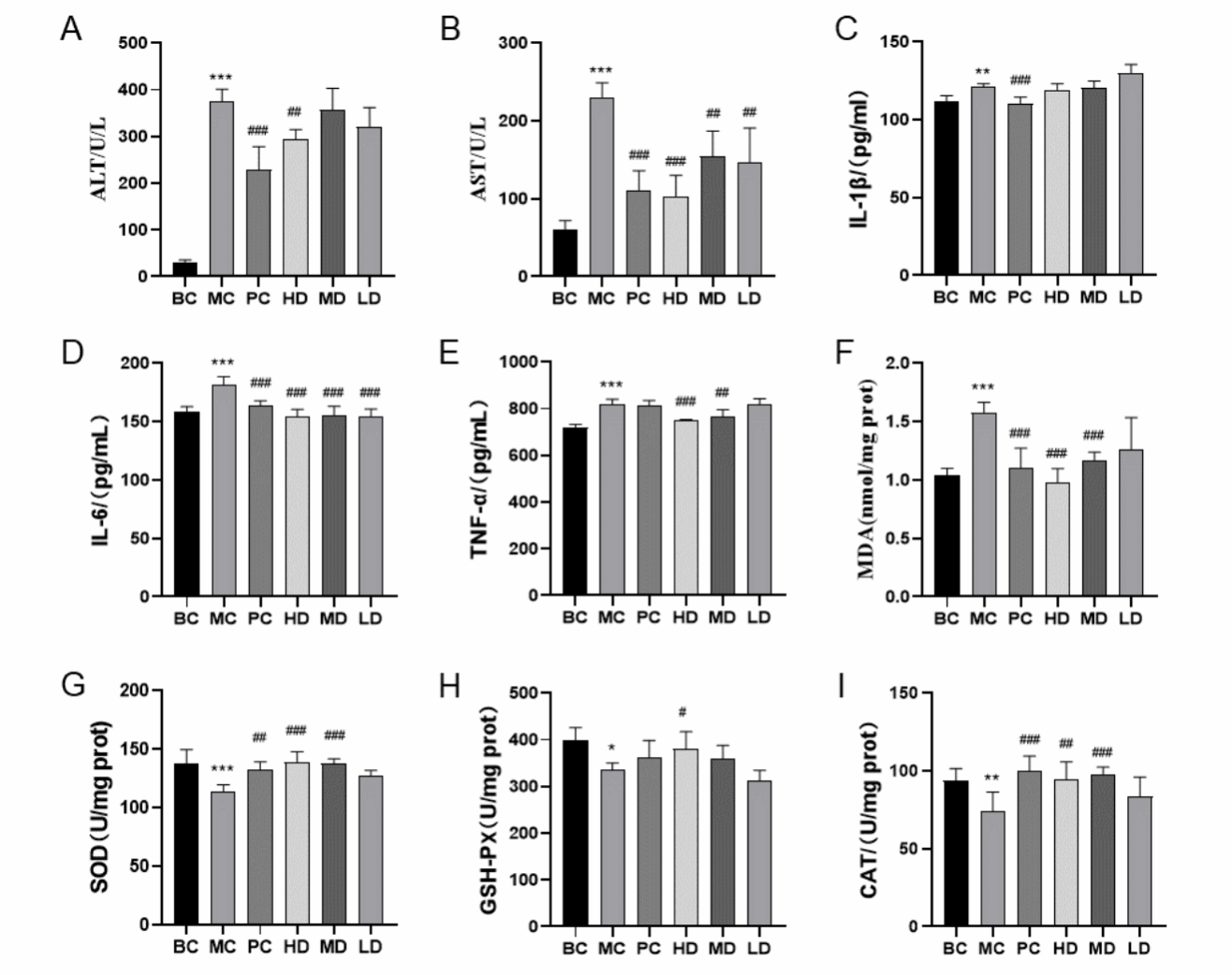
Fig. 1 Effect of KSO on serum ALT and AST content, serum cytokine content and antioxidant capacity of mice.
4. KSO对血清细胞因子的影响
在图1C、D和E中,模型组的IL-6、IL-1β和TNF-α水平较BC组明显升高(P < 0.01, P < 0.001),表明CCl4可以增加小鼠体内炎症因子的活性。与MC组比较,KSO高、中、低剂量组可显著降低IL-6水平(P < 0.001), KSO高、中剂量组可显著降低TNF-α水平(P < 0.001, P < 0.01),但对IL-1β无明显影响,且KSO对TNF-α的调节作用呈剂量依赖性。PC组IL-6和IL-1β水平降低。结果表明,KSO可恢复CCl4诱导的炎症反应,并通过调节细胞因子水平提高抗炎活性。
5. KSO对小鼠抗氧化能力的影响
在图1F、G、H、I中,与BC组相比,MC组CAT、SOD、GSH-Px水平显著降低(P < 0.001),MDA水平显著升高(P < 0.001),表明模型建立成功。与MC组相比,HD组CAT、SOD、GSH-Px水平显著升高(P < 0.05, P < 0.01, P < 0.001),MDA水平显著降低(P < 0.001)。MD组CAT、SOD水平显著升高(P < 0.001), MDA水平显著降低(P < 0.001),而LD组差异无统计学意义。提示KSO对MDA的作用呈剂量依赖性。PC组MDA水平显著降低(P < 0.05), SOD和CAT水平显著升高(P < 0.01, P < 0.001),GSH-Px活性差异无统计学意义。KSO高、中剂量组显著改善CCl4诱导的急性肝损伤小鼠的氧化应激水平。
6. CCl4诱导的肝组织学改变
图2中,BC组小鼠肝脏细胞分布规则,排列整齐,形态正常,染色后可见细胞核和细胞质。MC组肝细胞出现大量细胞肿胀,甚至在肝细胞中部区域出现气球样变性特征,同时出现大量细胞坏死,周围可见大量炎性细胞浸润入肝内。这些结果表明,CCl4注射对小鼠肝脏造成了严重的损伤。KSO HD组和LD组小鼠肝脏肿胀坏死面积明显减少,但排列稀疏。KSO治疗减轻了CCl4诱导的小鼠肝细胞坏死,说明KSO能有效保护肝细胞免受CCl4损伤。
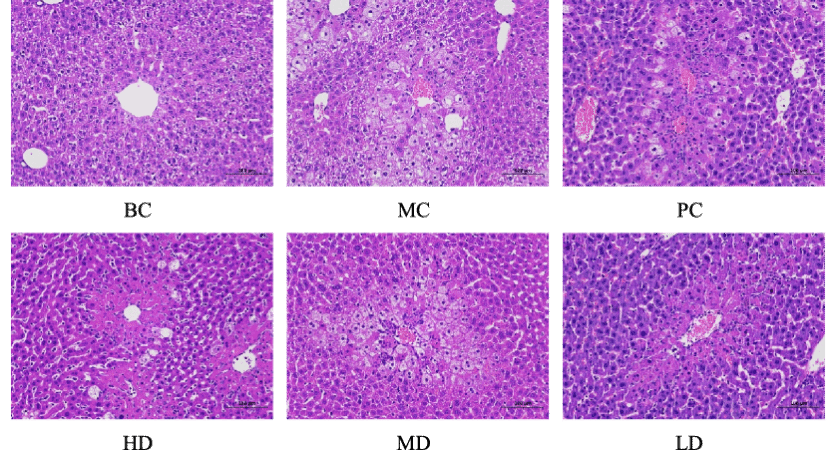
Fig. 2. Effect of KSO on liver tissue of mice with ALI.
7. KSO对ALI小鼠盲肠内容物代谢物的影响
基于UPLC-MS对小鼠盲肠内容物进行代谢组学分析。应用PLS-DA(图3A)揭示KSO的干预效果,观察到BC、MC和HD组有明显的聚集性。OPLS-DA评分图(图3B和C)清晰地分离了不同组肝脏样本的代谢轮廓,模型组相对于BC组的R2=0.98, Q2=0.01,给药组相对于模型组的R2=0.94, Q2=-0.08。
在火山图(图3D和E, VIP > 1和P < 0.05)中,与空白组相比,模型组共筛选出57个差异代谢物,其中25个差异代谢物显著上调,32个差异代谢物显著下调。与模型组相比,KSO给药组共筛选出56个差异代谢物,其中24个代谢物显著上调,32个代谢物显著下调。KSO改善急性肝损伤的潜在生物标志物包括α- D-葡萄糖、尿苷、鸟苷、核黄素、α-乳糖、胸腺嘧啶、6-羟基烟酸、13,14-二氢前列腺素E1和2,3-dinor-8-epi-prostaglandin F2α。
基于KEGG对不同分组的盲肠内容物代谢物进行代谢通路富集分析。在图3F中,KSO组显著影响色氨酸代谢、ABC转运体、胆汁分泌、蛋白质消化吸收、碳水化合物消化吸收。
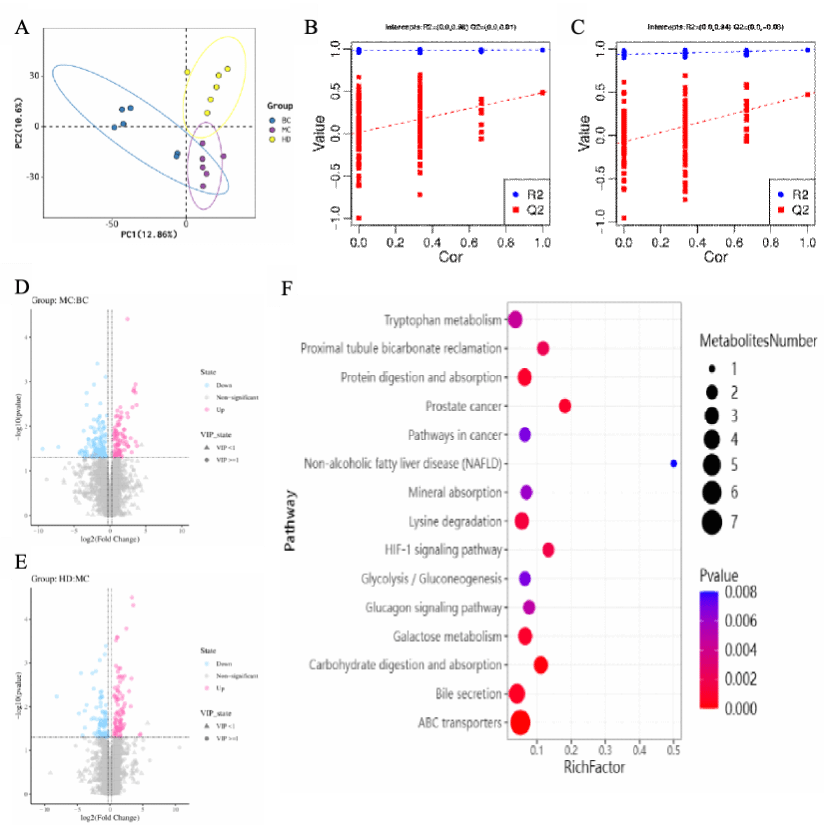
Fig. 3. Effects of KSO on metabolomics in mice with ALI.
8. KSO调节ALI小鼠的肠道菌群
由于CCl4会导致肠道菌群组成的改变,我们通过16S rDNA高通量测序分析来研究KSO对CCl4处理小鼠肠道菌群的影响。Ace指数和Chao指数是评价物种丰富度和多样性的常用指标。如图4A和B所示,不同组别的Ace和Chao指数不同。在我们的研究中,MC组的群落多样性和丰度显著低于BC组,KSO给药后恢复。为反映不同样本间多样性的差异,对样本进行组间beta多样性分析。在图4C中,KSO处理的ALI小鼠的肠道菌群组成与MC存在显著差异,说明KSO对ALI小鼠肠道微生物的结构组成具有良好的作用。
群落组成分析显示,在门水平(图4E),厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是小鼠肠道菌群的主要优势类群,占所有细菌的95%以上,其次是变形菌门(Proteobacteria)。与KSO MC组相比,KSO LD组拟杆菌门(Bacteroidetes)丰度增加,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)丰度降低。为了进一步了解肠道菌群的变化,我们分析了优势菌门在属水平的相对丰度。在图4F中,肠道菌群主要由Ruminococcus、Oscillospira、Coprococcus、Bacteroides和Prevotella组成。CCl4干扰后,粪球菌属(Coprococcus)、脱硫弧菌属(Desulfovibrio)、Roseburia丰度升高,瘤胃球菌属(Ruminococcus)、拟杆菌属(Bacteroides)丰度降低。KSO处理后,瘤胃球菌属(Ruminococcus)、振荡螺菌属(Oscillospira)、普雷沃菌属(Prevotella)的丰度升高,脱硫弧菌属(Desulfovibrio)和Roseburia的丰度降低。
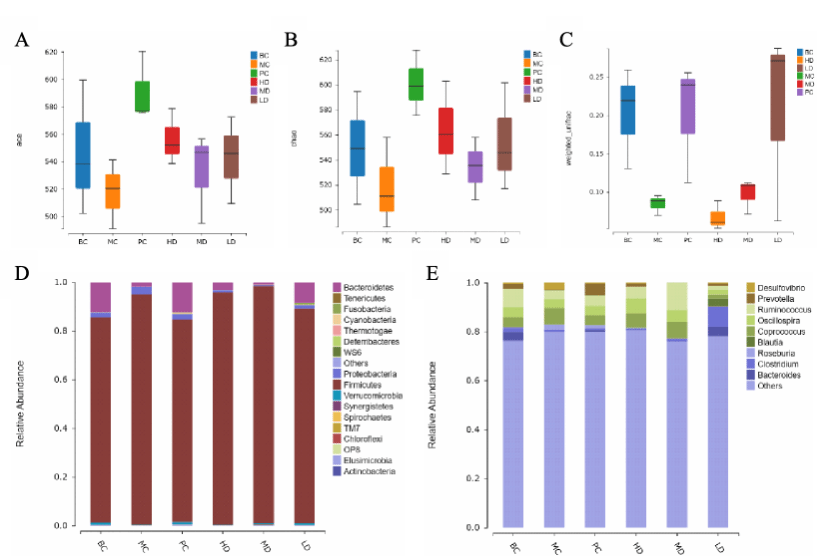
Fig. 4. Differences in community richness and diversity (A, B and C), Relative abundances of phylum (D) and genus (E) horizontal dominant groups
9. 差异代谢物与微生物的相关性分析
为了探索肠道菌群变化与代谢物之间的功能相关性,我们进行了相关性分析。可以发现,肠道菌群与代谢物之间存在明显的相关性。如图8所示,一些菌群与多种代谢物的关联较强,包括Ruminococcus、Streptococcus、Butyricimonas、Rikenella、Oscillospira、Bacteroidetes和Proteobacteria。和肠道菌群密切相关的代谢产物有尿苷、蛋氨酸亚砜、雌马酚、甘氨酸-L-亮氨酸、多肽、血管素、缬丙氨酸、鸟苷、6-姜辣醇和2,3-dinor-8-epi-prostaglandin F2α。
如图5所示,肠道菌群Ruminococcus、Streptococcus、Butyricimonas、Rikenella和Morganella与代谢产物褪黑素、α-乳糖、L-苏氨酸和α- D-葡萄糖显著相关。Oscillospira与2,3-dinor-8-epi-prostaglandin F2α和松香酸显著相关。Prevotella与甘氨酰-L-亮氨酸、雌马酚和2,3-dinor-8-epi-prostaglandin F2α显著相关。Bacteroidetes和Proteobacteria与胸腺嘧啶显著相关。TM7与吲哚、8-羟基喹啉、2-羟基喹啉显著相关。这些关系提示肠道菌群可能影响CCl4诱导的ALI小鼠的粪便代谢物。
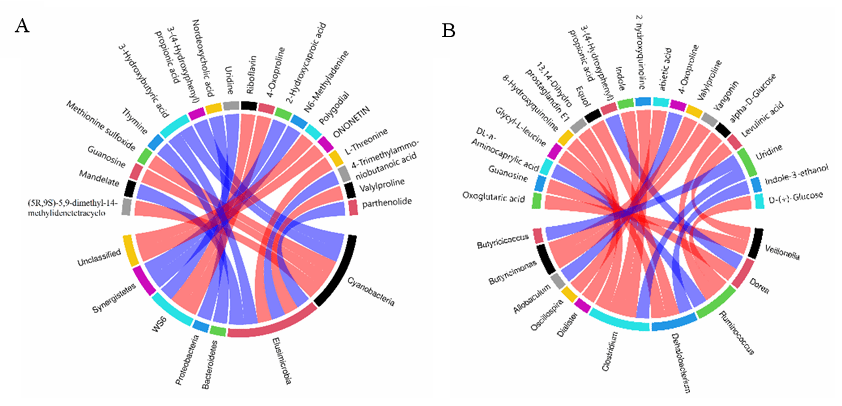
Fig. 5. Correlation chords of metabolomic differences between intestinal microbiota and cecal contents at phylum level (A) and genus level (B)
10. 网络药理学分析与验证
通过网络药理学分析,探索KSO对ALI有影响的潜在化合物和分子靶点。从KSO中鉴定12个脂肪酸组分,检索到对应的141个靶点,同时检索到ALI靶点7246个。成分靶点和疾病靶点求交集,确定130个共有靶点。
图6A为10个脂肪酸组分与130个交集靶点的关系网络图。结合PPI网络中的高频节点分析(图6B), Nr3c1、Ptgs2、Ppara、Pparg、Fabp1、Nos2、Rela和Serpine1位于网络中心。基于候选靶点进行GO和KEGG通路富集分析,确定相关通路和功能。GO分析(图6C)显示,这些靶点调控细胞增殖、凋亡、生长和炎症反应。KEGG通路(图6D)富集出27条代谢通路,包括HIF -1信号通路、前列腺癌、胰岛素抵抗等代谢通路。
这些预测为KSO保护ALI与炎症和脂肪酸相关靶点相关提供了科学信息。这些靶点在体内进行了验证。在图7中,与BC组相比,MC组中Ptgs2、Nos2、Serpine1 mRNA的表达显著增加,Ppara、Pparg mRNA的表达显著降低,KSO处理后均有不同程度的恢复。结果表明,KSO恢复了CCl4诱导的ALI相关mRNA的表达。
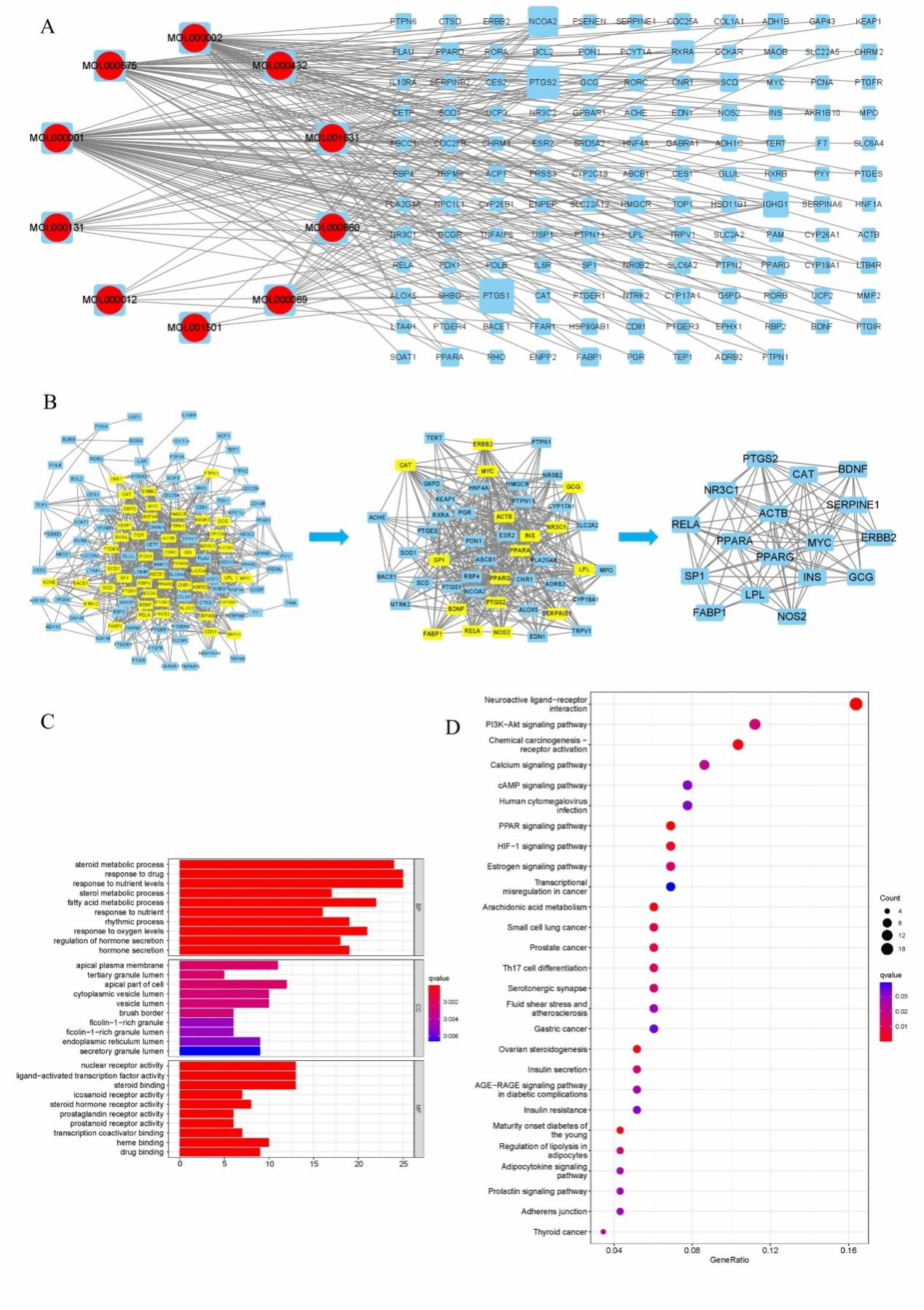
Fig. 6. Network construction, pathway and functional enrichment analysis of KSO in the treatment of ALI.
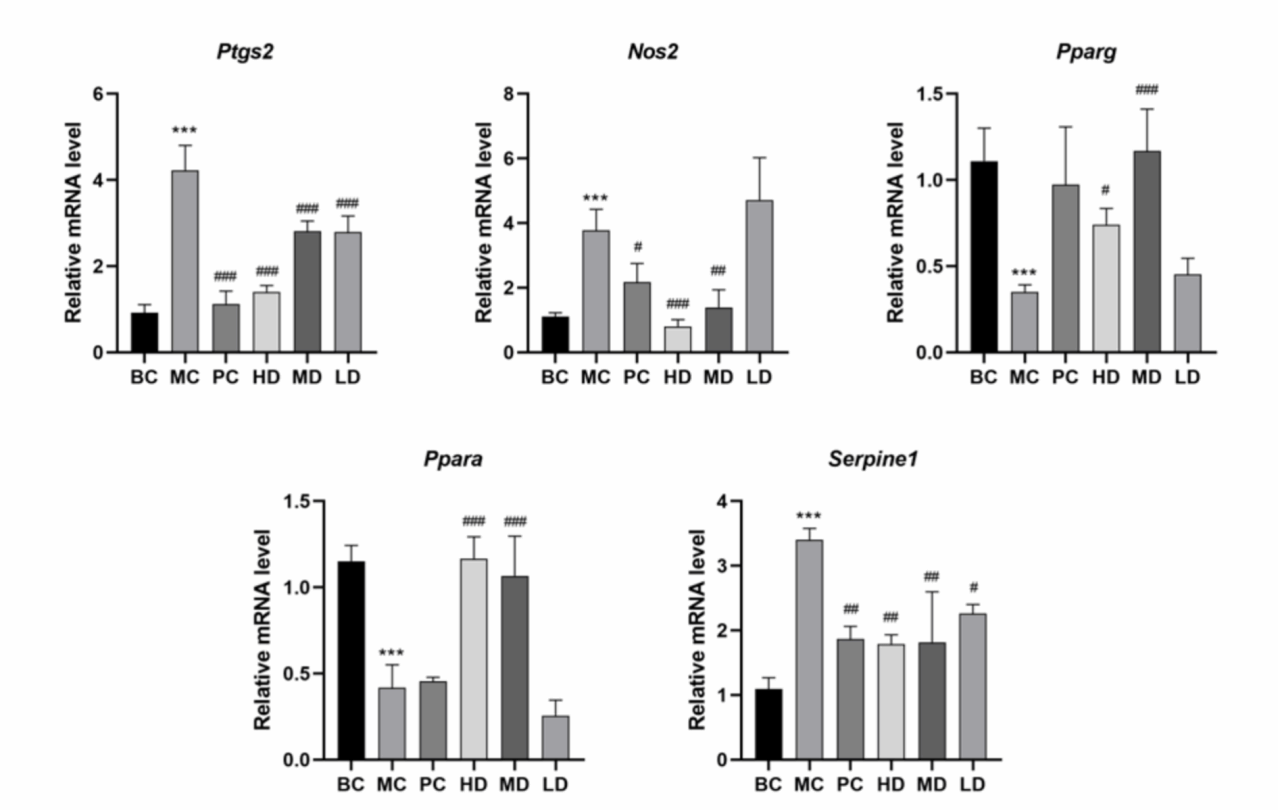
Fig. 7. Effect of KSO on mRNA expression levels of Ppara, Pparg, Ptgs2, Nos2 and Serpine1 in liver of mice
Conclusions
KSO具有肝组织保护作用,降低血清炎症因子水平,增强机体抗氧化防御能力,控制代谢紊乱,促进能量和氨基酸代谢,增加菌群丰度,增强菌群结构,维持肠道环境稳态。我们发现了肠道微生物群、糖脂代谢和胆汁生成之间的有趣联系。这种相关性可能在KSO对ALI的治疗效果中起关键作用。此外,网络药理学分析和体内实验验证发现了KSO脂肪酸成分治疗ALI的潜在机制,可能通过PTGS2、 NOS2、 PPARA、PPARG和SREPINE1影响PPAR信号通路和炎症通路。