该成果以“Isobavachromene ameliorates insulin resistance via inactivating the MAPK/NF-κB signaling pathway” 为题发表在中科院TOP 1区期刊Food Science and Human Wellness杂志(IF 5.6)。

Introduction
胰岛素作为一种重要的生物活性物质,在人体外周和中枢组织的能量产生、代谢以及细胞存活和增殖中起着至关重要的作用,胰岛素抵抗(insulin resistance,IR)会加剧2型糖尿病(T2DM)的发生和发展。肥胖是IR的主要驱动因素,也会导致T2DM患病率增加。作为胰岛素的关键靶组织,脂肪组织中的慢性炎症是导致IR发生和发展的核心因素。 研究表明,从天然产物中提取的活性成分可通过不同途径增加胰岛素的敏感性,对IR具有一定的改善作用。因此,我们从补骨脂中分离出一种异补骨脂色烯查尔酮(Isobavachromene,IB),这是一种已报道具有抗菌活性的类黄酮,但IB是否以及如何改善葡萄糖稳态和胰岛素抵抗仍是未知的。本研究通过观察IB对3T3-L1脂肪细胞葡萄糖摄取的影响以及对RAW 264.7巨噬细胞和3T3-L1脂肪细胞炎症反应的影响,探讨IB通过降低脂肪细胞炎症反应从而改善IR的作用机制。
Results and discussion
1.IB改善3T3-L1脂肪细胞的胰岛素抵抗
为明确异补骨脂色烯查尔酮(IB,图1A)是否能改善胰岛素抵抗(IR),作者首先评估了其对3T3-L1脂肪细胞的影响。MTT试验显示,IB在25 - 100 µM浓度范围内无细胞毒性(图1B)。在3T3-L1脂肪细胞中成功建立IR模型后,作者发现IB显著促进脂肪细胞的葡萄糖摄取能力(图1C)。此外,IB显著增强了GLUT4的转运(图1D),且效果优于阳性对照原钒酸钠。此外,通过分子对接预测IB在胰岛素受体的Arg 118和Phe 64位点具有良好的结合能。为阐明IB在脂肪细胞中的降糖机制,作者发现IB激活了IRS-1/PI-3K/Akt轴,显著增加PI-3K(P110α)的表达以及IRS-1和AKT的磷酸化水平,最有效浓度为50 μM(图1E)。为进一步验证此结果,作者使用了特异性通路抑制剂Wortmannin,并检测了PI-3K(P110α)和AKT的表达水平(图1F)。结果表明,IB可通过激活PI-3K/AKT信号通路改善3T3-L1脂肪细胞的IR。
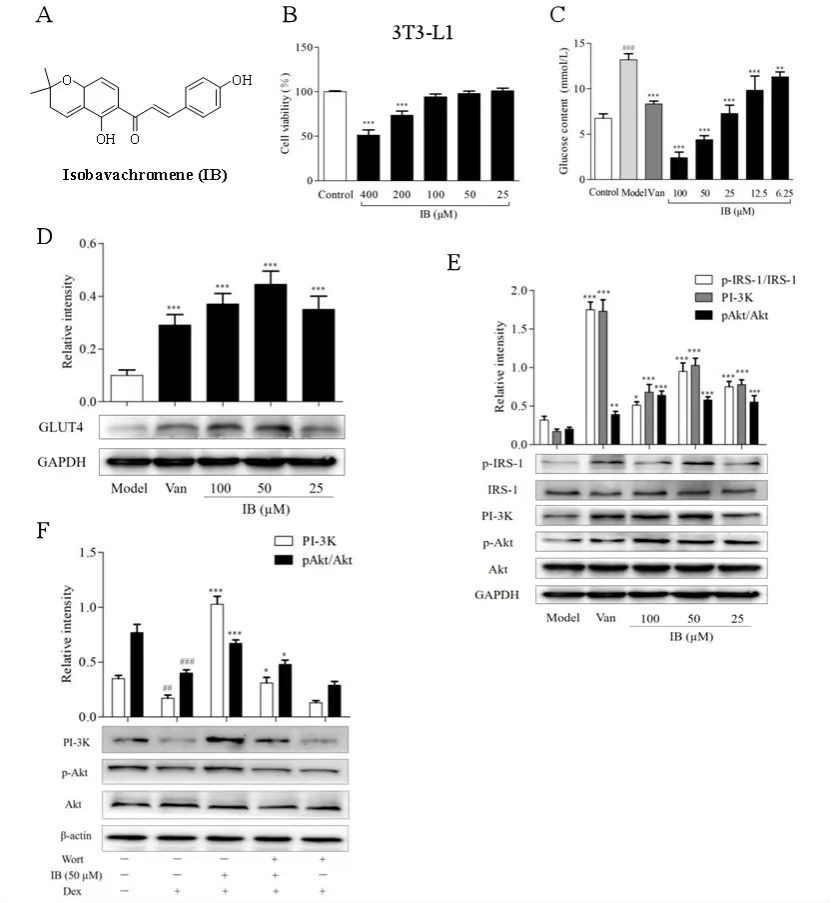
图1 IB通过IRS-1/PI-3K/Akt信号通路改善3T3-L1脂肪细胞中的胰岛素抵抗(IR)。
(A) 异补骨脂色烯查尔酮(IB)的化学结构。(B) IB对3T3-L1脂肪细胞活力的影响。(C) IB对3T3-L1脂肪细胞上清液中葡萄糖含量的影响。(D) Western blot检测IB对GLUT 4的影响。(E) IB对IRS1/PI3K/Akt相关蛋白表达的影响。(F) IB对通路抑制剂Wortmannin(Wort,100 nM)作用后PI3K/Akt信号通路相关蛋白表达的影响。
2.IB对RAW 264.7巨噬细胞炎症水平的影响
胰岛素抵抗(IR)通常伴有慢性炎症状态。因此,作者使用LPS诱导的RAW 264.7巨噬细胞炎症模型,进一步研究了IB的抗炎作用。MTT试验显示,IB在25-100 µM浓度范围内无细胞毒性(图2A)。在50 μM剂量下,IB显著降低了一氧化氮(NO)(M1巨噬细胞的标志物)(图2B)和诱导型一氧化氮合酶(iNOS,图2C)的分泌。此外,炎症因子TNF-α的产生增加对肥胖个体中IR的产生具有重要影响,作者发现IB显著降低了TNF-α的分泌能力(图2D)和转录水平(图2E)。IL-6(图2F,G)和IL-1β(图2H,I)(细胞因子风暴中的关键分子)也被IB显著降低。以上结果表明,IB对RAW264.7巨噬细胞具有良好的抗炎作用。

图2 IB对LPS诱导的炎性巨噬细胞的影响。
(A) IB对RAW 264.7巨噬细胞活力的影响。(B) 硝酸还原酶法测定IB对RAW264.7巨噬细胞NO分泌的影响。(C) RT-qPCR检测IB对RAW 264.7巨噬细胞中iNOS表达的影响。(D,E)IB对RAW 264.7巨噬细胞中TNF-α分泌及mRNA水平的影响。(F,G)IB对RAW264.7巨噬细胞中IL-6分泌及mRNA水平的影响。(H,I)IB对RAW264.7巨噬细胞中IL-1β泌及mRNA水平的影响。
3.IB通过MAPK/NF-κB信号通路抑制RAW 264.7巨噬细胞中的炎症水平
MAPK和NF-κB在炎性反应中发挥重要作用。在确定了IB具有良好抗炎作用的基础上,作者试图阐明其抗炎机制。通过Western blot发现IB显著抑制RAW 264.7巨噬细胞中P38、ERK和JNK蛋白的磷酸化(图3A)。此外,TNF-α水平升高表明NF-κB可以通过复合物p65成分的核转位激活炎症基因。因此,作者进一步研究了IB对NF-κB信号通路的抗炎特性。观察到IB显著抑制RAW 264.7巨噬细胞中NF-κB和iκB的磷酸化(图3B),以及NF- κB的核转位(图3C)。这些结果表明,IB通过MAPK/NF- κB信号通路抑制LPS诱导的炎症。
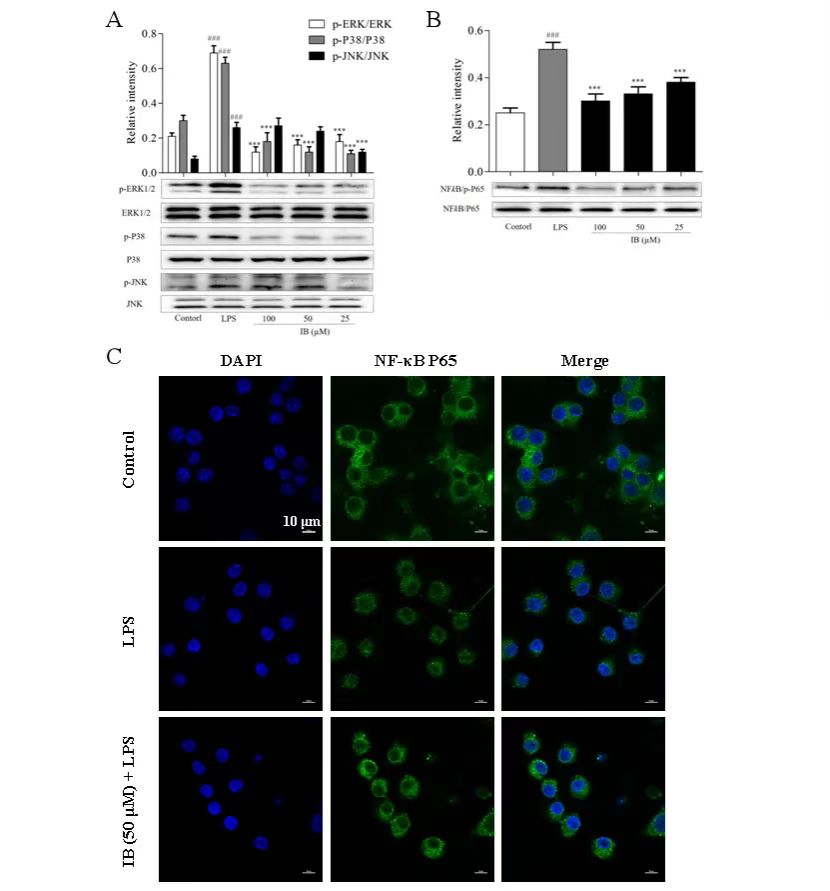
图3 IB通过NF-κB和MAPK信号通路抑制RAW 264.7巨噬细胞中的炎症水平。
(A)通过Western blot分析IB对MAPK信号传导途径相关蛋白表达的影响。(B)通过Western blot分析IB对NF-κB信号通路相关蛋白表达的影响。(C)用激光共聚焦显微镜观察IB对p65核转位的影响。
4.IB改善3T3-L1脂肪细胞中炎症导致的胰岛素抵抗
为阐明3T3-L1脂肪细胞中炎症和IR之间的因果关系。作者首先使用倒置显微镜捕获Transwell小室的图像,发现IB抑制RAW 264.7巨噬细胞向脂肪细胞的浸润(图4A)。MCP-1和MIP-1α是肥胖脂肪组织中巨噬细胞增殖的潜在刺激因子,可导致脂肪细胞炎症,作者发现IB显著降低了这些趋化因子的分泌(图4B)及转录水平(图4C,D),以及脂肪细胞中TNF-α诱导的IL-6(图4E)和IL-1β(图4F)的转录水平。 此外,COX2是炎症反应中常见的诱导酶,其转录(图4G)和蛋白质表达水平(图4H)也被IB显著抑制。
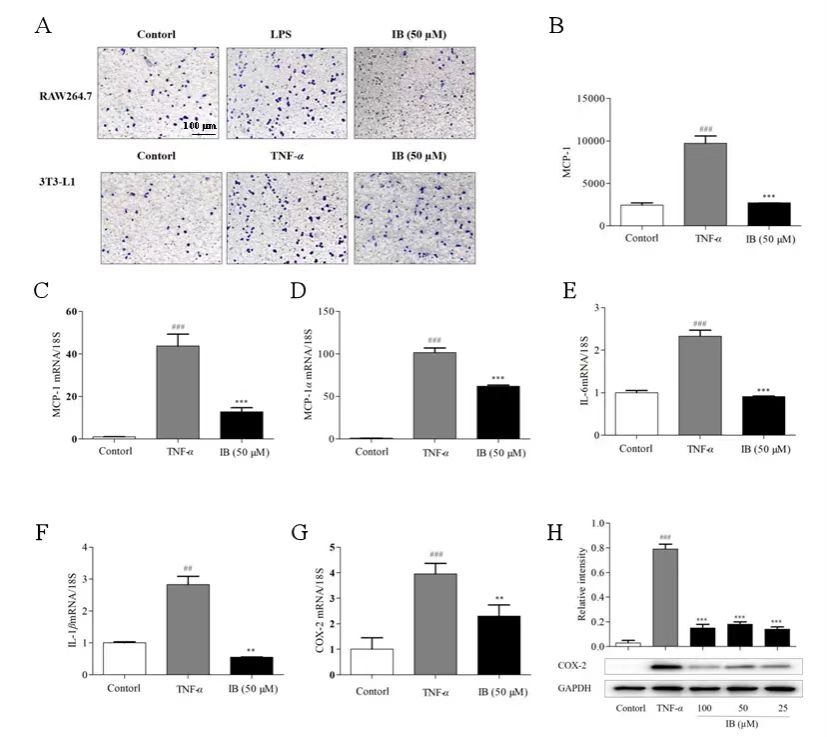
图4 IB通过抗炎调节3T3-L1脂肪细胞的IR。
(A) IB对RAW 264.7巨噬细胞向3T3-L1脂肪细胞迁移的影响。(B) IB对MCP-1分泌的影响。(C,D)RT-qPCR以检测IB对3T3-L1脂肪细胞中MCP-1和MIP-1α表达的影响。(E,F)通过RT-qPCR定量3T3-L1脂肪细胞中IL-6和IL-1 β的mRNA表达。(G) RT-qPCR检测IB对3T3-L1脂肪细胞中COX-2 mRNA水平的影响。 (H)Western blot检测3T3-L1脂肪细胞中COX-2蛋白的表达水平。
5.IB影响炎性3T3-L1脂肪细胞中的MAPK/NF-κB信号通路
在明确IB改善由炎症引起的IR后,作者试图进一步阐明其机制。使用Western blot发现IB(25-50μM)显著降低了NF- κB的磷酸化水平(图5A),以及JNK的磷酸化水平(图5B),进一步表明IB通过MAPK/NF-κB信号通路改善炎性3T3-L1脂肪细胞中的胰岛素抵抗。
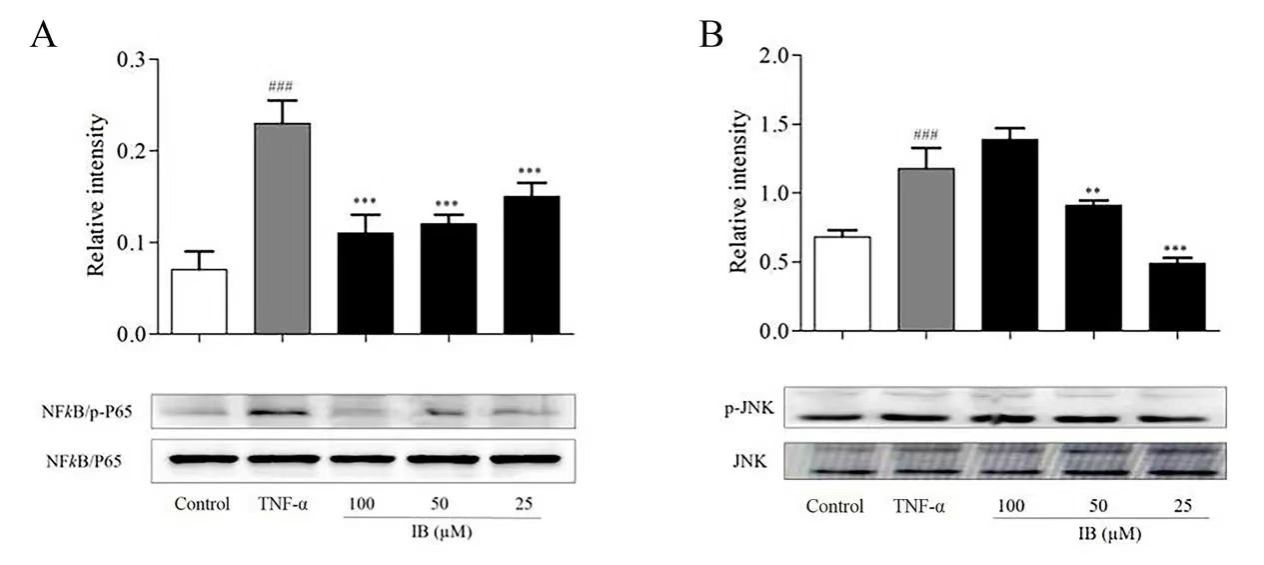
图5 IB调节炎性3T3-L1脂肪细胞中的MAPK/NF- κB信号通路。
(A)IB降低3T3-L1脂肪细胞中NF-κ B的磷酸化水平。(B)IB降低3T3-L1脂肪细胞中JNK的磷酸化水平。
Conclusion
本研究阐明了IB改善巨噬细胞炎症以及脂肪细胞中炎症导致胰岛素抵抗的机制。作者发现IB通过抑制NF-κB和MAPK信号通路改善炎症,从而增强受炎症影响的胰岛素敏感性。以上内容为IB相关降糖药物的开发提供了基础。