
与传统方法相比,酵母菌高密度发酵在酒精生产领域具有很多优势。该技术不仅可以提高酒精产量和设备利用率,还可以降低劳动力和能源的消耗。酿酒酵母(Saccharomyces cerevisiae)等酵母菌对高底物浓度引起的高渗透压的抵抗力直接影响酒精的产量。在高葡萄糖胁迫下,一些酵母菌,如酿酒酵母和蜂蜜接合酵母(Zygosaccharomyces rouxii),可以通过调整繁殖模式,产生保护性代谢产物,如合成甘油、海藻糖及相关的氧化酶,从而耐受恶劣条件。在转录组水平方面,已有一些关于酵母对高糖胁迫反应的研究报道。微阵列分析表明,当暴露于20%(m/V)葡萄糖时,酿酒酵母PSY316的海藻糖和甘油生物合成基因上调。最近的研究还发现,当在高渗条件下培养时,酿酒酵母可以通过积累细胞内的海藻糖来保护细胞,并调节重组酵母完整性相关基因的表达,以及过氧化氢酶和超氧化物歧化酶基因的表达,从而提高浓缩液的发酵能力。此外还发现,高葡萄糖胁迫能上调酿酒酵母的糖酵解和磷酸戊糖途径的基因,下调酿酒酵母中参与嘧啶、嘌呤、赖氨酸和组氨酸新生生物合成的基因。在高糖胁迫下,参与呼吸和HOG途径的酿酒酵母基因有重要的转录变化。此外,有研究表明,细胞壁较坚硬的鲁氏接合酵母菌株比细胞壁较柔软的菌株渗透耐受性差。
前期研究发现,从蜂蜜中分离出的蜂蜜接合酵母LGL-1(Z. mellis 6-7431)菌株在500 g/L葡萄糖浓度下能产生最大浓度的乙醇,并能耐受700 g/L的高葡萄糖胁迫,表明其在高密度发酵中的应用潜力。同时,研究了蜂蜜接合酵母LGL-1对高葡萄糖胁迫的代谢特性,发现该菌株在渗透胁迫下能改变繁殖模式,产生甘油和海藻糖。目前,对蜂蜜接合酵母高糖耐受机制的研究仅限于代谢水平,对相关代谢途径和关键基因还没有全面认识。仲恺农业工程学院的Gongliang Liu、Yongtao Fei、Weidong Bai等在本文采用转录组分析法分析了高糖胁迫条件下基因表达的差异。通过实时定量PCR(q-RT PCR)验证了转录组测序的准确性,阐明了蜂蜜接合酵母对高浓度葡萄糖耐受的渗透机制。
与300 g/L葡萄糖浓度下LGL-1的基因表达相比,500 g/L高葡萄糖胁迫下的DEGs主要注释为细胞成分分类下的“细胞”、“细胞部分”和“细胞器”,分子功能分类下的“结合”和“催化活性”,生物过程分类下的“细胞过程”、“代谢过程”和“单体过程”(图1c)。与500 g/L葡萄糖浓度下的基因表达相比,在700 g/L高葡萄糖胁迫下,LGL-1的DEGs也被注释为3种不同分类下相同的8个部分(图1b)。与300 g/L葡萄糖浓度下的基因表达相比,700 g/L高葡萄糖胁迫下LGL-1的DEGs在细胞成分分类下主要注释到与上述组相同的部分。但以下项目的DEGs与前几组不同,如分子功能分类下的“成分”、“大分子化合物”,生物过程分类下的“对刺激的反应”、“定位”、“生物调控”等(图1a)。
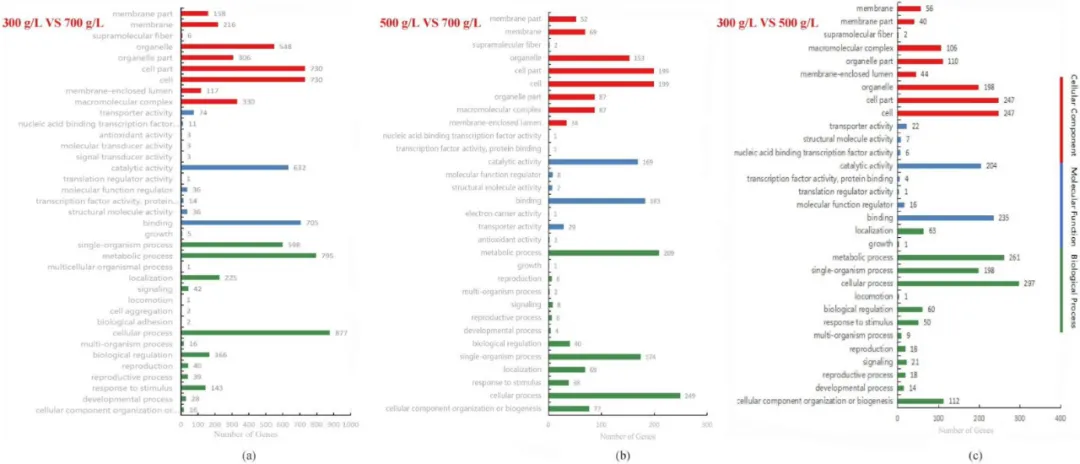
图1 基于GO分析的不同浓度葡萄糖LGL-1中的DEG
L-30-VS-L-50、L-50-VS-L-70和L-30-VS-L-70组的DEGs数量最多,被归入“代谢途径”部分。在上述3个葡萄糖浓度组中识别出的DEGs有2380个,分别被注释到75、75和108条代谢途径中。随着葡萄糖浓度的增加,注释到“代谢途径”的DEG数量明显提高。此外,与300 g/L葡萄糖相比,700 g/L葡萄糖中“响应刺激”的DEGs显著增加到143个,而其他两组的DEGs分别只有38个和50个(图1)。此外,在高葡萄糖胁迫下,参与细胞生长和LGL-1生物合成的DEGs发生了明显的变化,包括“真核生物的核糖体生物生成”、“细胞周期酵母”、“减数分裂酵母”和“次生代谢产物的生物合成”。此外,高葡萄糖应激还影响LGL-1的氨基酸和蛋白质合成,包括“氨基酸的生物合成”、“内质网的蛋白质加工”、“抗生素的生物合成”和“不同环境下的微生物代谢”。
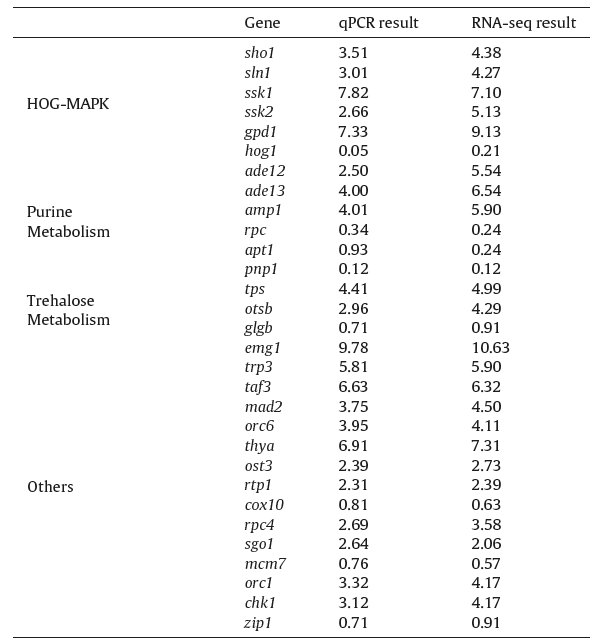
在转录组分析的基础上,确定了参与HOG-MAPK信号转导途径、嘌呤代谢、海藻糖代谢等生物过程的30个DEG。表达有显著变化的基因有30个,其中包括25个明显上调的基因和5个明显下调的基因。q-PCR分析结果如表1所示,表明两种方法分析结果基本一致。
表1 通过qPCR验证RNA-seq结果
当暴露于高渗胁迫时,酵母中启动了一系列复杂的适应性程序,包括细胞周期进程的延长、转录和翻译的变化以及渗透甘油的合成。这些反应主要由HOG-MAPK通路控制,HOG-MAPK通路是多种真核生物中进化保守的信号传递单元。细胞内相容性渗透甘油的合成和积累是HOG-MAPK被高渗胁迫激活的重要适应方式。鉴定了HOG途径中的关键基因(图2),其中包括hog(丝裂原激活蛋白激酶)、gpd(甘油-3-磷酸脱氢酶)、sln(渗透感应组氨酸蛋白激酶)、sho(渗透感测子)、ssk(丝裂原激活蛋白激酶)、pck(磷酸烯醇丙酮酸羧化激酶)和msb(信号黏蛋白)。以300 g/L葡萄糖浓度为参考,在700 g/L高葡萄糖胁迫下,LGL-1中sho1、sk2、gpd基因的表达水平分别显著提高了3.51、2.66、7.33倍(图2),从而导致甘油的积累,保护了LGL-1的细胞。此外,Hog1能够通过调节转录因子控制基因表达,如msn1、msn4、msn5(应激反应型转录激活因子)、hot(高渗透压诱导型转录蛋白)等,这些转录因子负责控制一系列渗透反应型基因的表达。以葡萄糖浓度300g/L和500g/L为参考,在700g/L高葡萄糖胁迫下,msn5基因的表达水平明显增加,但msn1和msn4基因的表达水平没有明显变化。在抵抗高渗透环境时,酿酒酵母和蜂蜜接合酵母也发现了类似的机制,即通过上调HOG-MAPK途径中Hog1、gpd和msn2等一系列基因的表达。因此,LGL-1的HOG途径被激活,成为保护细胞免受高糖渗透胁迫的重要途径。
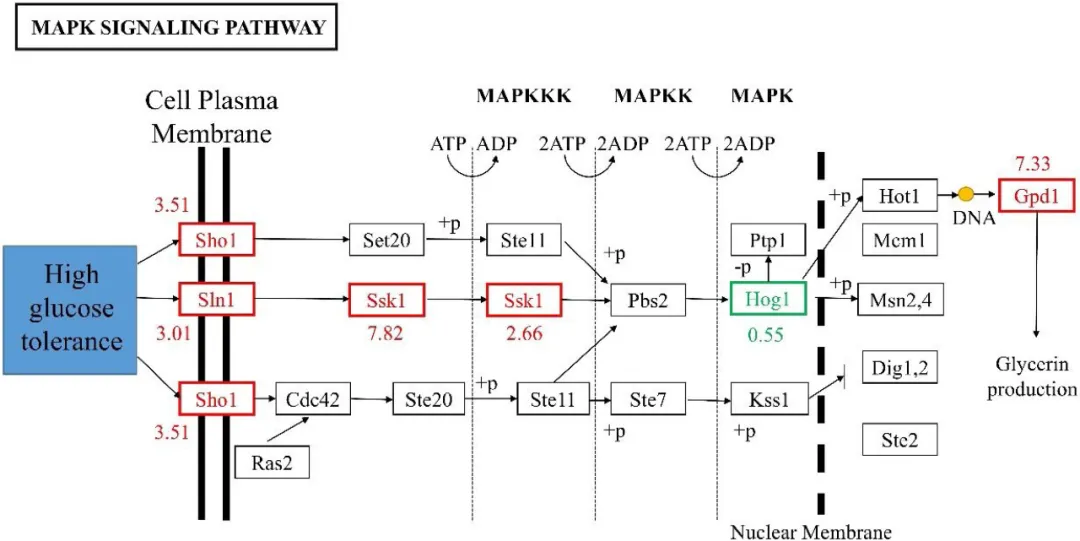
红色字体表示上调基因,绿色字体表示下调基因。
图2 HOG-MAPK信号转导途径的qPCR
海藻糖是常用的能源物质,为生物体的合成代谢提供能量。此外,由于其特殊的物理特性,它还在保护酵母细胞的完整性,使其免受渗透压引起的各种损伤方面发挥着重要作用。参与海藻糖代谢的基因很多,其中包括tps(海藻糖-磷酸合成酶)、ottsB(海藻糖-6-磷酸磷酸酶复合物)、nth(α-海藻酶)、tsl(海藻糖合成酶复合物调节亚单位)和ath(α-海藻酶)。有报道称,敲除ath基因,过量表达tps基因,可提高细胞内海藻糖浓度,进而改善高渗耐受性。在LGL-1中鉴定出tps、tsl、ath和nth基因,在700 g/L高糖胁迫下,以300 g/L葡萄糖浓度为参考,tps1和ottsB基因分别以4.41倍和2.96倍显著上调(图3)。之前的研究表明,蜂蜜接合酵母LGL-1可以在高糖条件下合成海藻糖,其细胞生长趋势与之相同,这一现象在酿酒酵母和德尔布有孢圆酵母等几种酵母中也有发现。实验证明,LGL-1在700 g/L的高糖胁迫下,通过增加tps1和ottsB等关键基因的表达,激活了海藻糖的合成途径,导致细胞内海藻糖的积累,以耐受高糖胁迫。

图3 海藻糖代谢的qPCR
高渗透压带来遗传物质的破坏,促进裂变酵母的DNA合成,以抵消DNA缺乏。在蜂蜜相关酵母中发现了几个参与DNA合成的基因,包括amd1(腺苷酸合成酶)、ade12、ade13(腺苷酸合成酶)、apt1和pnp1(嘌呤核苷磷酸化酶)(图4)。基因amd1编码的蛋白参与了IMP从AMP生物合成的第一条途径。以300 g/L葡萄糖浓度为参照,在500 g/L和700 g/L高葡萄糖胁迫下,随着葡萄糖浓度的增加,amd1、ade12和ade13基因均上调,以应对高渗透压引起的DNA破坏。在700 g/L高葡萄糖胁迫下,ade12和ade13的表达水平显著提高。
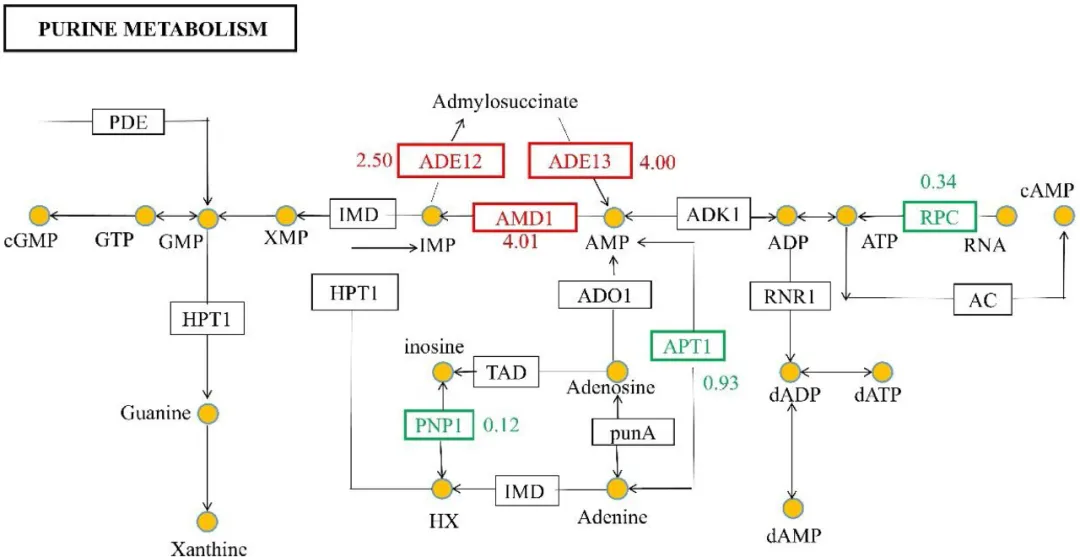
图4 嘌呤代谢的qPCR
Comparative transcriptomics analysis of Zygosaccharomyces mellis under high-glucose stress
Gongliang Liua, Xinyu Bia, Changli Taob, Yongtao Feia,*,Sujuan Gaoa, Jinglong Lianga, Weidong Baia,*
a College of Light Industry and Food Science, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, China
b Guangdong Province Key Laboratory for Biotechnology Drug Candidates, School of Biosciences and Biopharmaceutics, Guangdong Pharmaceutical University, Guangzhou 510006, China
Abstract
该文章《Comparative transcriptomics analysis of Zygosaccharomyces mellis under high-glucose stress》发表于Food Science and Human Wellness 2021年第1期54-62页。点击下方阅读原文即可查看摘要原文。
翻译:梁安琪;编辑:袁月;责编:张睿梅
图片来源于文章原文摄图网
